Table of Contents
I. Tính chất vật lý của Clo
Ở điều kiện thường, clo là chất khí màu vàng lục, mùi xốc, rất độc.

Khí clo nặng gấp 2,5 lần không khí
Clo tan vừa phải trong nước và tan nhiều trong các dung môi hữu cơ như: hexan, CCl4…
II. Tính chất hóa học của Clo
Trong hợp chất clo có các số oxi hóa: -1, +1, +3, +5, +7.
Nguyên tử clo có độ âm điện lớn (3,16) nên dễ nhận thêm 1electron để trở thành ion Cl-. Vì vậy, tính chất hóa học cơ bản của clo là tính oxi hóa mạnh. Thể hiện qua các phản ứng sau:
1. Clo tác dụng với kim loại
Clo tác dụng được hầu hết kim loại tạo thành muối clorua. Phản ứng nhanh và tỏa nhiều nhiệt.

2. Clo tác dụng với hidro
Khi chiếu sáng phản ứng xảy ra nhanh và có thể nổ:
Như vậy, khi phản ứng với kim loại và hiđro, clo thể hiện tính oxi hóa mạnh.
3. Clo tác dụng với nước và dung dịch kiềm
Khi tan vào nước, một phần clo tác dụng chậm với nước tạo ra hỗn hợp axit clohiđric và axit hipoclorơ có tính tẩy màu do H O là chất oxi hóa rất mạnh. Vì thế clo ẩm có tính tẩy màu.
Với dung dịch kiềm, clo tác dụng dễ dàng tạo thành hỗn hợp muối của các axit HCl và HClO
Trong các phản ứng này clo vừa là chất oxi hóa vừa là chất khử.
4. Clo tác dụng với muối của các halogen khác
Clo không oxi hóa được F- nhưng oxi hóa dễ dàng ion Br- và I- trong muối:
Điều này chứng minh tính oxi hóa: F2 > Cl2 > Br2 >I2.
5. Clo tác dụng với các chất khử khác
Clo oxi hóa được nhiều chất:
III. Trạng thái tự nhiên của Clo
Trong tự nhiên, clo có hai đồng vị bền là 35Cl (75,77%) và 37Cl (24,23%)
→
Chỉ tồn tại dạng hợp chất: NaCl có trong nước biển và muối mỏ, khoáng cacnalit KCl.MgCl2.6H2O, Axit HCl có trong dịch dạ dày người và động vật.
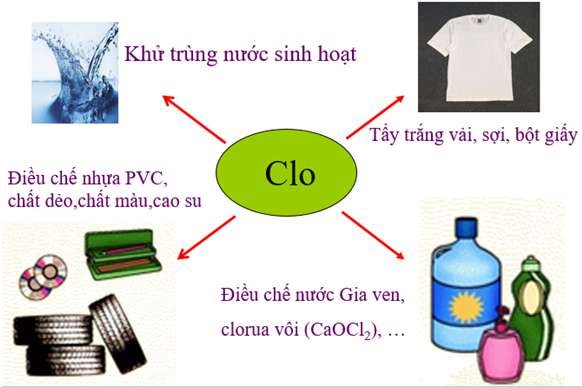
IV. Ứng dụng của Clo
V. Phương pháp điều chế Clo
Nguyên tắc là oxi hóa Cl- thành Cl2
1. Điều chế Clo trong phòng thí nghiệm
Cho HCl đặc tác dụng với các chất oxi hóa mạnh như: KMnO4, MnO2, KClO3…
MnO2 + 4HCl
2KMnO4 + 16HCl → 2MnCl2 +2KCl + 5Cl2↑ + 8H2O
KClO3 + 6HCl → KCl + 3Cl2 + 3H2O

(1) là dung dịch HCl đặc.
(2) MnO2.
(3) Dung dịch NaCl để giữ khí HCl
(4) Dung dịch H2SO4 đặc giữ hơi nước.
(5) Cl2 khô.
(6) Bông tẩm dung dịch NaOH.
2. Sản xuất Clo trong công nghiệp
Điện phân dung dịch NaCl bão hòa có màng ngăn để sản xuất xút (NaOH), đồng thời thu được khí clo và hiđro (clo là sản phẩm phụ của công nghệ sản xuất xút)
2NaCl + 2H2O
H2↑: Cực âm (catot)
Cl2↑: Cực dương (anot)
VI. Bài tập luyện tập về Clo của trường Nguyễn Khuyến
Câu 1. Phát biểu nào sau đây là sai?
- Trong các phản ứng với kim loại và hiđro clo chỉ thể hiện tính oxi hóa.
- Trong hợp chất clo có thể có các số oxi hóa: -1, +1, +3, +5, +7.
- Clo là nguyên tố có độ âm điện lớn nhất.
- Trong tự nhiên clo chỉ tồn tại dạng hợp chất.
ĐÁP ÁN
Chọn đáp đúng là C.
Độ âm điện Cl (3,16) < O (3,44) < F (3,98)
Câu 2. Phản ứng nào sau đây clo vừa là chất oxi hóa vừa là chất khử?
- 2Fe + 3Cl2 → 2FeCl3.
- Mg + Cl2 → MgCl2.
- Cl2 + H2 → 2HCl.
- Cl2 + 2NaOH → NaCl + NaClO + H2O.
ĐÁP ÁN
Chọn đáp D.
Trong các phản ứng ở A, B,C số oxi hóa của clo giảm từ 0 xuống -1 → Clo là chất oxi hóa
Trong phản ứng D:
Số oxi hóa clo vừa tăng vừa giảm nên clo đóng vai trò vừa là chất oxi hóa vừa là chất khử.
Câu 3. (Câu 1/ SGK nâng cao trang 125- Hóa 10) Tìm câu đúng trong các câu sau đây:
- Clo là chất khí không tan trong nước.
- Clo có số oxi hóa -1 trong mọi hợp chất.
- Clo có tính oxi hóa mạnh hơn brom và iot.
- Clo tồn tại trong tự nhiên dưới dạng đơn chất và hợp chất.
ĐÁP ÁN
Chọn đáp án B:
Tính oxi hóa F2> Cl2> Br2> I2.
A sai vì clo tan vừa phải trong nước
C sai vì trong hợp chất clo có thể có các số oxi hóa: -1, +1, +3, +5, +7.
D sai vì clo chỉ tồn tại dạng hợp chất trong tự nhiên.
Câu 4. Phương trình phản ứng nào sau đây là dùng để điều chế clo trong công nghiệp ?
A. MnO2 + 4
B. 2KMnO4 + 16
C. 2NaCl + 2H2O
D. KClO3 + 6HCl → KCl + 3Cl2 + 3H2O
ĐÁP ÁN
Chọn đáp án C.
Các phương trình ở A, B, D là dùng để điều chế clo trong phòng thí nghiệm.
Câu 5. Chất nào sau đây được dùng để làm khô khí Cl2 ẩm?
- CaO.
- Na2SO3 khan.
- Dung dịch H2SO4đậm đặc.
- Dung dịch NaOH đặc.
ĐÁP ÁN
Chọn đáp án C.
Vì H2SO4 đặc là chất háo nước và hút ẩm mạnh và không tác dụng với khí clo.
Câu 6. Đốt cháy 15,7 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 40,55 gam hỗn hợp muối. Thể tích khí Cl2 (đktc) đã phản ứng là
A. 7,84 lít.
B. 15,68 lít.
C. 8,96 lít.
D. 10,08 lít.
ĐÁP ÁN
Chọn đáp án A.
Bảo toàn khối lượng ta có:
Câu 7. Nguyên tử 17Cl . Em hãy chọn đúng cấu hình electron của ion Cl- là :
A. 1s22s22p63s23p5.
B. 1s22s22p63s23p4.
C. 1s22s22p63s23p6.
D. 1s22s22p63s23p7.
ĐÁP ÁN
Chọn đáp án C.
17Cl: Có cấu hình electron là: 1s22s22p63s23p5
→ Cấu hình electron của Cl- là: 1s22s22p63s23p6
Câu 8. Cho 9,75 gam kim loại M hóa trị n tác dụng với khí clo dư thì thu được 20,4 gam muối. Kim loại M là:
A. Al.
B. Cu.
C. Fe.
D. Zn.
ĐÁP ÁN
Chọn đáp án D.
Hướng dẫn giải:
PTHH:
2M + nCl2 → 2MCln
Tỉ lệ:
Theo đề bài: MolMCln=
Theo PTHH MolM = MolMCln
⇒
⇔ M=32,5n
⇔
GV: Nguyễn Văn Quy
Trường THCS-THPT Nguyễn Khuyến.
