Cục Quản lý dược cho biết các cơ quan khoa học ở Singapore và Thụy Sĩ cũng có cảnh báo tương tự. Cùng dịp này, Cục đã có văn bản gửi Viện Kiểm nghiệm thuốc, các cơ sở sản xuất, yêu cầu cơ sở sản xuất thuốc thành phẩm chứa Ranitidine chỉ được đưa các lô không tạp chất NDMA vào sản xuất, trường hợp có tạp chất thì không được vượt giới hạn cho phép.
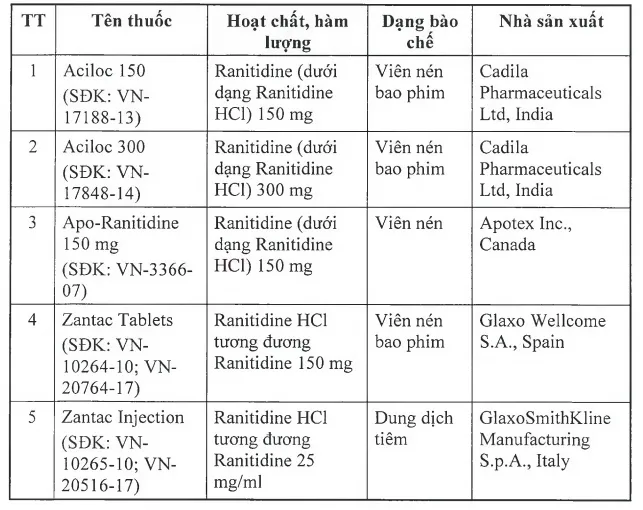
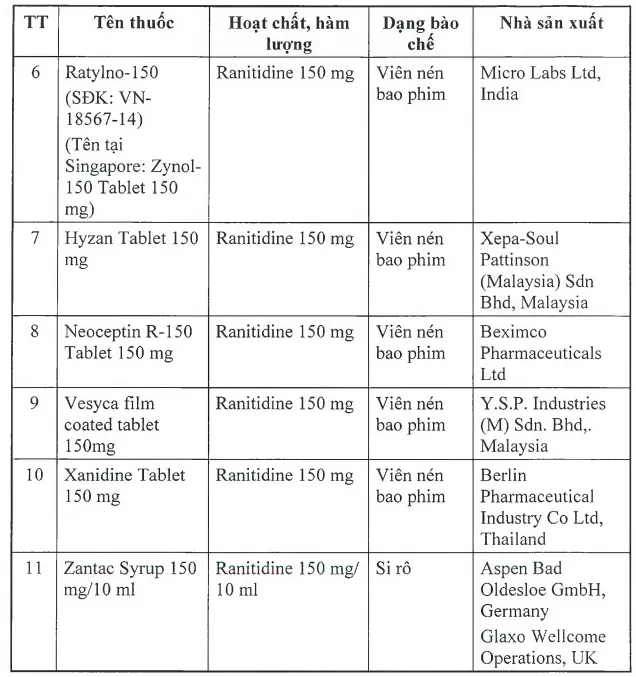
Danh sách chi tiết 11 loại thuốc chứa tạp chất gây ung thư bị thu hồi
Đồng thời Cục yêu cầu các cơ sở nhập khẩu nguyên liệu chỉ được nhập các lô đạt tiêu chuẩn chất lượng, đảm bảo nguyên liệu và thuốc thành phẩm không chứa tạp chất vượt mức cho phép. Với các thuốc nhập khẩu, đơn vị nhập khẩu phải lưu trữ từng lô thuốc này để đánh giá.
Cục Quản lý dược yêu cầu các Công ty nhập khẩu thuốc phối hợp với nhà phân phối thuốc thông báo thu hồi tất cả các lô thuốc thành phấm nêu trên tới các cơ sở bán buôn, bán lẻ, sử dụng thuốc và tiến hành thu hồi toàn bộ các lô thuốc này. Gửi báo cáo thu hồi về Cục Quản lý Dược trong vòng 01 tháng kể từ ngày ký Công văn này.
Cục Quản lý dược cũng đề nghị Sở Y tế các tỉnh thành phố thông báo việc thu hồi các cơ sở kinh doanh, sử dụng thuốc trên địa bàn. Công bố thông tin việc thu hồi tất cả các thuốc thành phẩm nêu trên trang TTĐT của Sở. Ngoài ra, kiểm tra và giám sát các Công ty nhập khẩu thuốc trên địa bàn thục hiện việc thu hồi các thuốc nêu trên.



